Exemplos De Bases Fortes E Fracas: Uma Abordagem Química, este artigo mergulha no fascinante mundo das bases químicas, explorando as diferenças cruciais entre bases fortes e fracas. Ao longo desta jornada, desvendaremos os conceitos fundamentais que regem o comportamento dessas substâncias, analisando suas propriedades e reações características.
Através de exemplos práticos e aplicações relevantes, compreenderemos a importância das bases fortes e fracas em diversos campos da ciência e da vida cotidiana.
Compreender a força de uma base é essencial para prever seu comportamento em soluções aquosas e em reações químicas. Bases fortes, como o hidróxido de sódio (NaOH), dissociam-se completamente em íons hidroxila (OH-) em solução, enquanto bases fracas, como o amoníaco (NH3), sofrem dissociação parcial.
Essa diferença na dissociação determina a capacidade de uma base de aumentar o pH de uma solução e sua reatividade com ácidos.
Conceitos Fundamentais
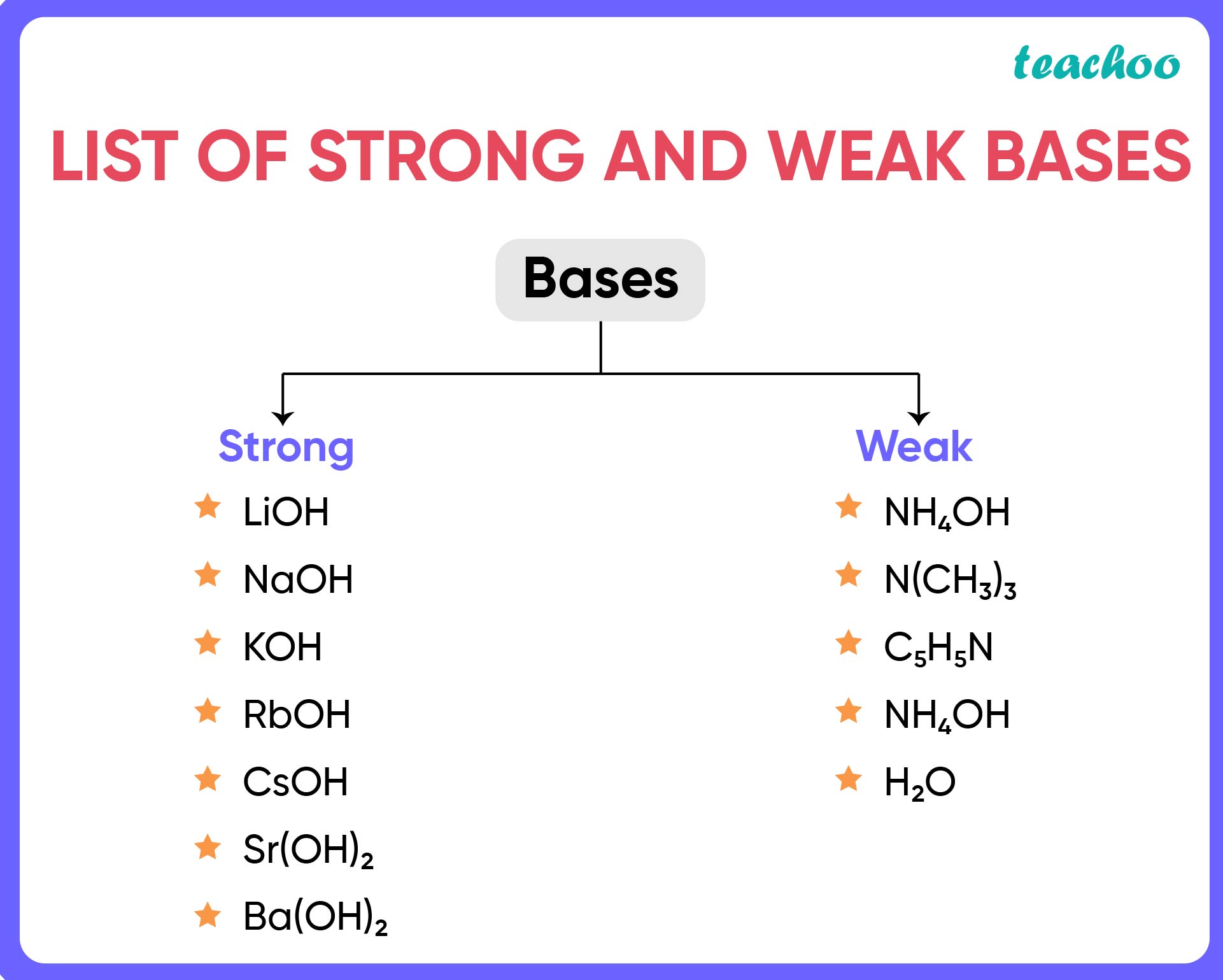
Em química, a força de uma base é medida pela sua capacidade de aceitar prótons (H+). As bases são classificadas em fortes e fracas, dependendo da sua capacidade de ionizar em solução aquosa.
Definição de Bases Fortes e Fracas
Uma base forte é uma substância que se ioniza completamente em solução aquosa, liberando íons hidroxila (OH-) em sua totalidade. Por outro lado, uma base fraca ioniza apenas parcialmente em solução aquosa, liberando uma quantidade menor de íons hidroxila.
Relação entre a Força da Base e a Liberação de Íons Hidroxila
A força de uma base está diretamente relacionada à sua capacidade de liberar íons hidroxila (OH-) em solução aquosa. Bases fortes se ionizam completamente, liberando uma grande quantidade de íons hidroxila, enquanto bases fracas se ionizam apenas parcialmente, liberando uma quantidade menor de íons hidroxila.
Exemplos de Bases Fortes e Fracas
As bases fortes geralmente são compostas por metais alcalinos e alcalinos terrosos, como hidróxidos de sódio (NaOH) e potássio (KOH). Já as bases fracas podem ser compostas por aminas, como amônia (NH3), ou por hidróxidos de metais de transição, como hidróxido de cobre (Cu(OH)2).
Uma base forte é aquela que se ioniza completamente em solução aquosa, liberando uma grande quantidade de íons hidroxila (OH-).
Uma base fraca é aquela que se ioniza apenas parcialmente em solução aquosa, liberando uma quantidade menor de íons hidroxila (OH-).
- Bases Fortes:
- Hidróxido de Sódio (NaOH)
- Hidróxido de Potássio (KOH)
- Hidróxido de Cálcio (Ca(OH)2)
- Hidróxido de Bário (Ba(OH)2)
- Bases Fracas:
- Amônia (NH3)
- Hidróxido de Alumínio (Al(OH)3)
- Hidróxido de Cobre (Cu(OH)2)
- Hidróxido de Ferro (Fe(OH)3)
Propriedades e Reações de Bases Fortes e Fracas: Exemplos De Bases Fortes E Fracas

As bases fortes e fracas diferem significativamente em suas propriedades e reatividade, influenciando seu comportamento em soluções aquosas e reações químicas. A compreensão dessas diferenças é crucial para a química, especialmente em áreas como a análise de soluções, reações de neutralização e síntese química.
Condutividade Elétrica
A condutividade elétrica de uma solução é determinada pela presença de íons livres que podem transportar corrente elétrica. As bases fortes, como o hidróxido de sódio (NaOH) e o hidróxido de potássio (KOH), dissociam-se completamente em água, liberando íons hidróxido (OH-) e cátions metálicos.
Essa dissociação completa resulta em uma alta concentração de íons livres, tornando as soluções de bases fortes excelentes condutoras de eletricidade.As bases fracas, por outro lado, dissociam-se apenas parcialmente em água, formando um equilíbrio entre a base não dissociada e seus íons.
Como resultado, a concentração de íons livres em soluções de bases fracas é menor do que em soluções de bases fortes, levando a uma condutividade elétrica mais baixa.
pH
O pH é uma medida da acidez ou alcalinidade de uma solução, sendo definido como o logaritmo negativo da concentração de íons hidrogênio (H+). As bases fortes, devido à sua completa dissociação em água, produzem uma alta concentração de íons hidróxido (OH-), o que reduz a concentração de íons hidrogênio (H+).
Portanto, as soluções de bases fortes têm um pH alto, geralmente acima de 12.As bases fracas, devido à sua dissociação parcial, produzem uma concentração menor de íons hidróxido (OH-), resultando em um pH mais baixo do que as bases fortes.
O pH das soluções de bases fracas geralmente varia entre 9 e 12.
Reação com Ácidos
A reação de uma base com um ácido é conhecida como reação de neutralização. Durante a reação, os íons hidrogênio (H+) do ácido reagem com os íons hidróxido (OH-) da base, formando água (H2O) e um sal.
H+ + OH- → H2O
A reação de neutralização de uma base forte com um ácido forte é completa e irreversível, pois os reagentes se dissociam completamente em água. Por exemplo, a reação de neutralização do ácido clorídrico (HCl) com o hidróxido de sódio (NaOH) produz cloreto de sódio (NaCl) e água:
HCl(aq) + NaOH(aq) → NaCl(aq) + H2O(l)
A reação de neutralização de uma base fraca com um ácido forte é reversível, pois a base fraca não se dissocia completamente. Por exemplo, a reação de neutralização do ácido clorídrico (HCl) com o amoníaco (NH3) produz cloreto de amônio (NH4Cl) e água:
HCl(aq) + NH3(aq) ⇌ NH4Cl(aq) + H2O(l)
Exemplos de Reações Químicas
Reação de neutralização de uma base forte com um ácido forte
NaOH(aq) + HCl(aq) → NaCl(aq) + H2O(l)
* Reação de neutralização de uma base fraca com um ácido forte:
NH3(aq) + HCl(aq) ⇌ NH4Cl(aq) + H2O(l)
* Reação de uma base forte com um óxido ácido:
NaOH(aq) + CO2(g) → Na2CO3(aq) + H2O(l)
* Reação de uma base fraca com um óxido ácido:
NH3(aq) + CO2(g) ⇌ NH4HCO3(aq)
Aplicações de Bases Fortes e Fracas
As bases fortes e fracas desempenham papéis cruciais em diversas áreas, desde a indústria até a medicina, devido às suas propriedades químicas únicas. Suas aplicações abrangem uma ampla gama de setores, impactando diretamente nossas vidas.
Aplicações Industriais
As bases fortes e fracas são amplamente utilizadas na indústria, principalmente em processos de produção e manufatura.
- A soda cáustica (NaOH), uma base forte, é fundamental na produção de papel, sabão, detergentes e biodiesel, além de ser utilizada no tratamento de água e na fabricação de produtos químicos.
- O hidróxido de cálcio (Ca(OH) 2), uma base fraca, é empregado na produção de argamassa, cimento e gesso, além de ser utilizado na agricultura para corrigir a acidez do solo.
- O amoníaco (NH 3), uma base fraca, é utilizado na produção de fertilizantes, explosivos e produtos de limpeza, além de ser utilizado na fabricação de plásticos e fibras sintéticas.
Aplicações na Agricultura
As bases fortes e fracas desempenham papéis importantes na agricultura, auxiliando no controle da acidez do solo e na produção de fertilizantes.
- O hidróxido de cálcio (Ca(OH) 2) é utilizado para corrigir a acidez do solo, tornando-o mais propício ao crescimento das plantas. O calcário agrícola, que contém carbonato de cálcio (CaCO 3), também é utilizado para o mesmo fim.
- O amoníaco (NH 3) é um componente fundamental de fertilizantes nitrogenados, essenciais para o crescimento das plantas.
Aplicações na Medicina
As bases fortes e fracas são utilizadas na medicina, principalmente na produção de medicamentos e na desinfecção.
- O hidróxido de magnésio (Mg(OH) 2), uma base fraca, é utilizado como antiácido para aliviar a azia e a indigestão.
- O bicarbonato de sódio (NaHCO 3), uma base fraca, é utilizado como antiácido e também como antisséptico.
- A água de amônia (NH 4OH), uma base fraca, é utilizada como antisséptico e também para aliviar a irritação da pele.
Aplicações em Produtos do Dia a Dia
As bases fortes e fracas estão presentes em diversos produtos do dia a dia, como sabões, detergentes e medicamentos.
| Nome da Base | Fórmula Química | Tipo de Base | Aplicação |
|---|---|---|---|
| Hidróxido de sódio | NaOH | Forte | Sabões, detergentes, produção de biodiesel, tratamento de água |
| Hidróxido de potássio | KOH | Forte | Sabões, detergentes, produção de biodiesel |
| Hidróxido de magnésio | Mg(OH)2 | Fraca | Antiácido |
| Bicarbonato de sódio | NaHCO3 | Fraca | Antiácido, antisséptico, fermento químico |
| Amoníaco | NH3 | Fraca | Produtos de limpeza, fertilizantes |
Ao final desta análise, teremos adquirido uma compreensão profunda dos conceitos de bases fortes e fracas, suas propriedades e reações, e suas aplicações práticas em diversos setores. A distinção entre esses dois tipos de bases é crucial para a compreensão de diversos fenômenos químicos e para o desenvolvimento de tecnologias que impactam a sociedade moderna.

