De Tres Exemplos De Substancia Simples Em Substancia Pura Composta – De Três Exemplos De Substância Simples Em Substância Pura Composta: Mergulhe nesse universo fascinante da química e explore a diferença crucial entre substâncias simples e compostas. Vamos desvendar os mistérios por trás da composição da matéria, analisando exemplos do cotidiano que demonstram claramente essa distinção fundamental. Prepare-se para uma jornada enriquecedora, onde a estrutura molecular e as propriedades químicas se revelam em detalhes, tornando o complexo acessível e intrigante.
Entender a diferença entre substâncias simples e compostas é essencial para compreender o mundo ao nosso redor. Substâncias simples são formadas por apenas um tipo de átomo, enquanto as compostas são formadas por dois ou mais tipos de átomos, quimicamente ligados. Exploraremos exemplos concretos, como o oxigênio (O2), o ferro (Fe) e a água (H2O), analisando suas propriedades e aplicações práticas.
Aprenderemos a identificar a composição e a estrutura dessas substâncias, desvendando seus segredos e sua importância na nossa vida diária.
Substâncias Puras: Simples e Compostas: De Tres Exemplos De Substancia Simples Em Substancia Pura Composta
A química, em sua essência, busca desvendar a composição da matéria. Neste contexto, a compreensão de substâncias puras, sejam elas simples ou compostas, é fundamental. Exploraremos a distinção entre esses tipos de substâncias, ilustrando com exemplos do nosso dia a dia e mergulhando na sua estrutura molecular.
Conceitos Fundamentais: Substâncias Puras e Misturas
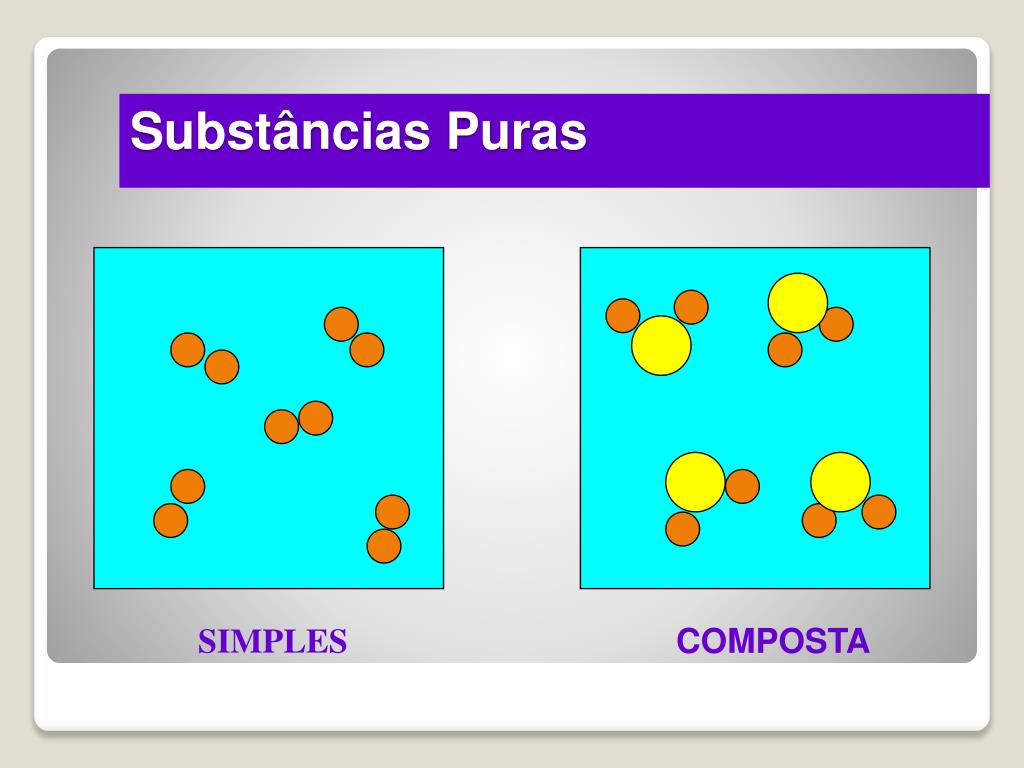
Uma substância pura é caracterizada por possuir composição química definida e constante, independente de sua origem ou método de obtenção. Essa composição invariável se reflete em propriedades físicas e químicas específicas e constantes. As substâncias puras podem ser classificadas em simples ou compostas.
Uma substância simples é formada por apenas um tipo de átomo. Já uma substância composta é formada por dois ou mais tipos de átomos, quimicamente unidos em proporções definidas.
Em contraste com as substâncias puras, temos as misturas. As misturas são combinações de duas ou mais substâncias, mantendo suas propriedades individuais. As misturas podem ser homogêneas, com composição uniforme em toda a sua extensão (como o ar atmosférico), ou heterogêneas, com composição não uniforme (como água e areia).
Substâncias Simples: Oxigênio, Nitrogênio e Ferro

Vamos detalhar três exemplos de substâncias simples, destacando suas propriedades.
| Nome da substância | Símbolo químico | Propriedade física | Propriedade química |
|---|---|---|---|
| Oxigênio | O2 | Ponto de fusão: -218,8 °C; Incolor e inodoro em condições normais. | Altamente reativo, essencial para a combustão e respiração. |
| Nitrogênio | N2 | Ponto de fusão: -210 °C; Incolor e inodoro em condições normais. | Relativamente inerte em condições normais, mas pode reagir em condições específicas formando compostos importantes. |
| Ferro | Fe | Ponto de fusão: 1538 °C; Sólido, prateado e brilhante. | Reage com oxigênio e água, formando óxidos de ferro (ferrugem). |
Substâncias Compostas: Água, Dióxido de Carbono e Cloreto de Sódio, De Tres Exemplos De Substancia Simples Em Substancia Pura Composta
Agora, analisaremos a composição e propriedades de três substâncias compostas.
A água (H2O) é formada por dois átomos de hidrogênio e um átomo de oxigênio, unidos por ligações covalentes. O dióxido de carbono (CO2) consiste em um átomo de carbono e dois átomos de oxigênio, também unidos por ligações covalentes. O cloreto de sódio (NaCl), ou sal de cozinha, é composto por íons de sódio (Na +) e cloro (Cl –), unidos por ligações iônicas.
Comparando as substâncias simples e compostas, notamos diferenças significativas em suas propriedades. Por exemplo, enquanto o oxigênio é um gás reativo, a água é um líquido relativamente inerte em condições normais. O ferro, sólido e metálico, difere significativamente do dióxido de carbono, um gás incolor e inodoro.
- Diferenças: As substâncias simples são formadas por um único tipo de átomo, enquanto as compostas por dois ou mais tipos.
- Diferenças: As propriedades físicas e químicas das substâncias simples e compostas variam amplamente devido à sua diferente composição e estrutura.
- Semelhanças: Ambas são substâncias puras com composição definida e propriedades constantes.
Representação das Substâncias: Modelos Moleculares

A representação da estrutura molecular nos ajuda a visualizar a organização atômica das substâncias. A água (H 2O ) possui uma estrutura angular, com o átomo de oxigênio no centro e os dois átomos de hidrogênio ligados a ele por ligações covalentes polares. O ângulo entre as ligações O-H é aproximadamente 104,5°. Já o dióxido de carbono (CO 2) apresenta uma estrutura linear, com o átomo de carbono no centro e os dois átomos de oxigênio ligados a ele por ligações covalentes duplas.
Aplicações das Substâncias no Cotidiano
As substâncias simples e compostas desempenham papéis cruciais em nossas vidas.
| Substância | Fórmula Química | Aplicação | Descrição da Aplicação |
|---|---|---|---|
| Oxigênio | O2 | Respiração | Essencial para a respiração celular, fornecendo energia para o corpo. |
| Nitrogênio | N2 | Fertilizantes | Componente essencial de fertilizantes nitrogenados, importantes para a agricultura. |
| Ferro | Fe | Construção | Utilizado na construção civil, na fabricação de aço e outros materiais. |
| Água | H2O | Bebida e Limpeza | Fundamental para a vida, usada para beber, cozinhar e limpar. |
| Dióxido de Carbono | CO2 | Refrigerantes | Utilizado em refrigerantes e bebidas carbonatadas. |
| Cloreto de Sódio | NaCl | Temperos e Conservação | Utilizado como tempero em alimentos e na conservação de carnes. |

